Een koolstofverbinding (organische chemie) bevat altijd C, vaak H en soms O.
Andere elementen zoals N en S laten we hier buiten beschouwing. De formule van de te onderzoeken stof is bijvoorbeeld: CxHyOz
Bij de elementenanalyse bepaal je de hoeveelheid C en H in (milli)gram.
Omdat je van te voren de massa van de totale stof hebt bepaald, kun je automatisch zien of er ook O in zat en zo ja, hoeveel.
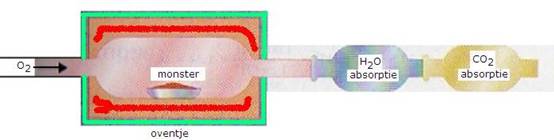
- Je weegt dus zeer zorgvuldig en nauwkeurig een bepaalde hoeveelheid van de te onderzoeken organische stof af (een monster).
Vervolgens wordt deze stof met veel zuurstof volledig verbrand; alle C wordt omgezet in CO2 en alle H in H2O.
- De hoeveelheid koolzuurgas en water wordt gewogen.
- Uit de hoeveelheid koolzuurgas bereken je de hoeveelheid C.
- Uit de hoeveelheid water bereken je de hoeveelheid H.
- Nu kun je nagaan of in de oorspronkelijke stof ook nog O zat; zo ja, dan kun je die hoeveelheid O nu ook opschrijven.
Als de oorspronkelijke hoeveelheid afgewogen stof méér is dan C + H samen, dan moet er dus ook O in zitten.
Je kent nu de massaverhouding C : H (: O)
Die massaverhouding moet je omzetten in de molverhouding door te delen door de bijbehorende atoommassa's van C, H (en O).
Je krijgt op die manier de verhouding x : y : z
Opdracht 15
Leg uit dat je op deze manier slechts de verhoudingsformule (CxHyOz)n kan bepalen en niet de echte molecuulmassa CxHyOz.
Het koolzuurgas en het water dat bij de elementenanalyse moeten worden bepaald, kunnen als volgt worden opgevangen en gewogen:
- Eerst wordt het water(g) opgevangen door een hygroscopische stof die voor en na de proef wordt gewogen.
Daarvoor kan bijvoorbeeld gebruikt worden: watervrij calciumchloride of watervrij kopersulfaat.
- Daarna wordt het koolzuurgas opgevangen bijvoorbeeld door een sterke base als kalk.
Ook dat kalk wordt voor en na de proef gewogen. Het verschil is dan het opgenomen gas.
Opdracht 16
Iemand verbrandt 100 cc benzine met overmaat droge en zuivere zuurstof.
De verbrandingsproducten worden achtereenvolgens geleid door watervrij calciumchloride en door kalk.
Het kalkbuisje wordt 220 gram zwaarder en het calciumchloridebuisje wordt 102 gram zwaarder.
Vervolgens wordt 10 cc benzine opgelost in 100 gram aceton; dit veroorzaakt een kookpunt van 57,40 °C.
Bepaal de molecuulformule van deze benzine.
terug naar start
