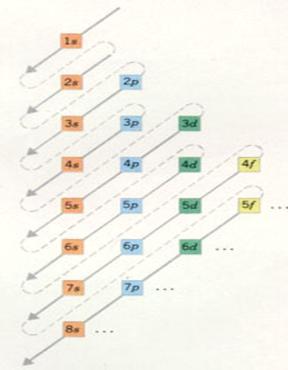
| Hoofschil 1 bestaat uit slechts 1 subnivo, | van het type s | met een maximaal aantal elektronen van: | 2 |
| Hoofdschil 2 heeft 2 onderschillen, subnivo's | van het type s e p | met een maximaal aantal elektronen van: | 2 en 6 |
| Hoofschil 3 heeft 3 subnivo's | van het type s p d | met een maximaal aantal elektronen van: | 2, 6 en 10 |
| Hoofdschil 4 heeft 4 subnivo's | van het type s p d f | met een maximaal aantal elektronen van: | 2, 6 , 10 en 14 |
De hoofdschillen 5 tot 7 zouden zich - theoretisch - kunnen onderverdelen in 5, 6 en 7 subnivo's.
Maar zulke grote atomen bestaan helemaal niet; daar is de natuur niet aan toe gekomen. Dus: |
|||
| Hoofdschil 5 verdeelt zich in vier subnivo's | van het type s p d f | met een maximaal aantal elektronen van: | 2, 6, 10 en 14 |
| Hoofdschil 6 verdeelt zich in drie subnivo's | van het type s p d | met een maximaal aantal elektronen van: | 2, 6 en 10 |
| Hoofschil 7 verdeelt zich in twee subnivo's | van het type s en p | met een maximaal aantal elektronen van: | 2 en 6 |