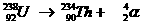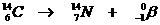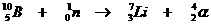chemische reactie
In een chemische reactie heb je reagentia die producten vormen; de producten zijn nieuwe stoffen met nieuwe eigenschappen.
Vaak worden natuurkundige veranderingen, zoals verdampen, tijdelijk genoemd en scheikundige veranderingen, zoals in reacties, blijvend.
Let wel, niet altijd is het onderscheid zo eenvoudig te maken.
Bij de chemische reacties is sprake van hergroepering van deeltjes
Er gaan geen deeltjes verloren en ook ontstaan niet spontaan nieuwe deeltjes; wat gebeurt is dat deeltjes van karakter veranderen en mogelijk van plaats en positie.
Je kunt het ook anders benaderen: bij een chemische reactie zullen deeltjes zich van elkaar verwijderen en daarna elkaar weer benaderen, maar dan in andere samenstelling.
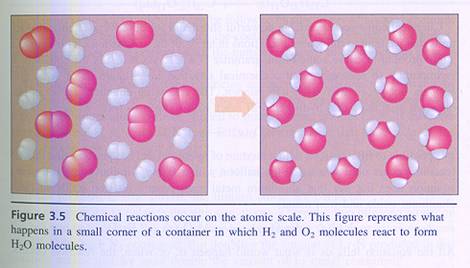
Bij een chemische reactie verandert het totaal aantal deeltjes niet.
Reacties tussen deeltjes vinden alleen echt plaats op het moment dat die deeltjes met elkaar in contact komen. De deeltjes moeten botsen.
En dan nog: niet elke botsing leidt tot reactie; die botsing moet ook op de juiste manier plaats vinden, dus moet effectief zijn en met voldoende energie.
De betrokken deeltjes kunnen atomen zijn, ionen of moleculen en kunnen heel verschillend zijn in grootte. Een macromolecuul kan reageren met een klein ion in de molverhouding 1:1.
Reactievergelijking
De veranderingen bij een chemische reactie worden aangeduid met een pijl:  , de reagerende stoffen ervoor, de producten erna.
, de reagerende stoffen ervoor, de producten erna.
Reagentia  Producten
(reactievergelijking)
Producten
(reactievergelijking)
Je kunt soms de reactie in woorden opschrijven (zoals: calcium met water  kalk en waterstof)
kalk en waterstof)
Maar normaal gebruiken we de scheikundige symbolen voor elk deelnemend deeltje en is de molverhouding te zien (de reactie is kloppend) evenals de aggregatietoestand (de fase).
Het totaal aantal deelnemende elementaire deeltjes (atomen en ionen, maar ook protonen, neutronen en elektronen) verandert niet tijdens een reactie.
Je begint de vergelijking natuurlijk met de juiste formules, maar als die eenmaal staan, dan moet je er voor zorgen dat het aantal deeltjes per element aan beide kanten van de pijl gelijk is. Er verdwijnen namelijk geen atomen tijdens een normale scheikundige reactie, en er komen er ook niet zomaar bij.
Met "coŽfficiŽnten" maken we de vergelijking kloppend: bijvoorbeeld, 2 moleculen van dit reageren met 3 ionen van dat enzovoort.
Die coŽfficiŽnten geven: de MOLverhouding.
Daarnaast moet je ook altijd even kijken naar de elektrische lading aan beide kanten. Ook die mag niet veranderen. Als er toch verschillen zijn, dan moet dat in orde gemaakt worden.
Algemeen:
- Je zorgt voor de juiste formules van de deelnemende stoffen;
- Je maakt de vergelijking kloppend met de coŽfficiŽnten;
- Je voegt de aggregatiestoestanden toe aan elke stof: (s) (l) (g) (aq); [(aq) is eigenlijk geen echte fase]
- Van ionen schrijf je normaal ook de ionenformules op in de vergelijking.
Alleen als er gerekend moet worden (reactieberekeningen), dan is het handig om de empirische formules te gebruiken, ook voor stoffen die uit ionen zijn opgebouwd.
Speciaal is de kernreactievergelijking. Daarin veranderen namelijk elementen, wat nooit gebeurt bij normale chemische reacties.
Toch gelden de normale regels van aantal deeltjes en de lading aan elke kant van de pijl net zo voor de kernreacties.
Voorbeelden:
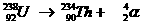
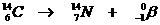
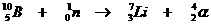

 , de reagerende stoffen ervoor, de producten erna.
, de reagerende stoffen ervoor, de producten erna.
 Producten
(reactievergelijking)
Producten
(reactievergelijking)
 kalk en waterstof)
kalk en waterstof)