Uit de bekende formule voor Kz (zie onderwerp 18) moet je de zgn. bufferformule kunnen afleiden:
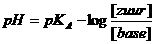
of:
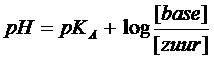
De Nederlandse manier om een zuur aan te geven is vaak: HZ, terwijl in het engels meestal HA wordt gebruikt.
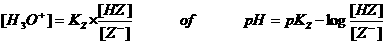
Om een goede bufferoplossing te verkrijgen moet je altijd een zuur kiezen met pKA dicht bij de gewenste pH.