benzeen
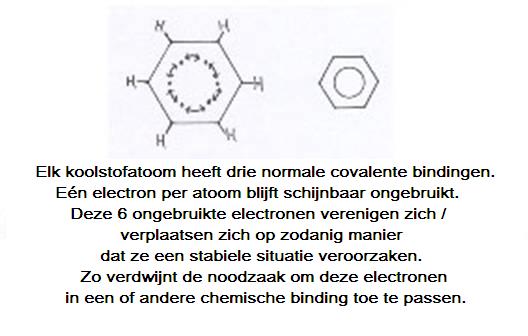
De benzeenring kun je opvatten als opgebouwd uit zes koolstofatomen, die elk drie van hun valentie-elektronen gebruiken voor bindingen met één H en twee buur-C's.
Van elk koolstofatoom is dan nog één valentie-elektron ongebruikt over, het is nog vrij. Dat zijn er dus zes in totaal.
Wat doen die zes vrije elektronen vervolgens: die vormen tezamen een soort ring-binding, van de gezamenlijke zes atomen.
Er is dus een bijzondere binding die we in de structuren aangeven met een cirkel. Op die manier is er tussen elk C-atoom precies dezelfde binding.
Opgelet: dit is wel een wat simpele weergave.
Preciezer nu, met de orbitalen 2s, 2px, 2py en 2pz.
Die drie: 2s en 2px en 2py van het Koolstofatoom kunnen mengen, en vormen dan drie nieuwe "hybride"-orbitalen: drie orbitalen sp2.
Deze zijn verantwoordelijk voor het aangaan van drie 'normale' verbindingen (we spreken van orbitaal-overlapping) met twee andere koolstofatomen en met één waterstofatoom; deze drie bindingen zijn van het type σ.
Daarnaast vormt zich dus tussen elke twee koolstofatomen een overlapping (binding) van 2pz-orbitalen.
Oftewel: in totaal zes bindingen van het type π.
substitutie aan benzeen
H-atomen van benzeen substitueren gaat gemakkelijk.
De stabiele structuur van de ring verliest zijn stabiele karakter daarbij niet. De 6 C-atomen blijven netjes aan elkaar verbonden, zonder enige verandering.
Er wordt gesubstitueerd aan benzeen met de groepen: nitro, amino, alkyl, sulfon en andere.

