 dus de massa van één molecuul water is 18 a.m.e.
dus de massa van één molecuul water is 18 a.m.e.
| Deeltje | Massa (g) | Massa (a.m.e) | Lading |
| Elektron | 9,1*10-28 | 0 | -1 |
| Neutron | 1,67495*10-24 | 1 | 0 |
| Proton | 1,67254*10-24 | 1 | +1 |
de atomaire massa-eenheid = het gemiddelde gewicht van één kerndeeltje (van één nucleon)Als dus een deeltje bijvoorbeeld 100 nucleonen bezit, dan zal de (molecuul)massa van dit deeltje 100 a.m.e. zijn.
 dus de massa van één molecuul water is 18 a.m.e.
dus de massa van één molecuul water is 18 a.m.e.
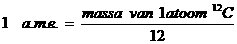
| < getal van Avogadro = 6.1023 |