Additie & Eliminatie
Additie en eleminatie zijn elkaars tegengestelde reacties.
Als twee moleculen zich verenigen door het openbreken van een onverzadigde binding, heb je additie.
Bij eliminatie ontstaan twee nieuwe moleculen uit één, waarbij één van die nieuwe onverzadigd wordt.
Een molecuul deelt zich in nieuwe moleculen terwijl sommige van die nieuwe moleculen onverzadigd worden, dus dubbele of drievoudige bindingen verkrijgen.
In het woord 'additie' zit het begrip opgesloten van 'toevoeging' (Eng: to add). Er wordt iets toegevoegd aan een molecuul
In het woord 'eliminatie' zit een ander begrip: 'wegwerken'. Er wordt iets verloren door een molecuul.
Propanol kan uitgangsstof zijn voor propeen in een eliminatie-reactie.
Het propanol moet een OH-groep kwijt + een H-atoom van een buur-C.
Zo vormt zich een watermolecuul en een extra binding tussen de twee C-atomen. Dit geeft propeen.
Onverzadigd
In een koolstofketen kun je dubbele of drievoudige bindingen hebben tussen de C-atomen. In dat geval wordt de stof "onverzadigd" genoemd, d.w.z. die dubbele bindingen kunnen opengaan en aan weerskanten atomen opnemen.
Zo'n binding gaat dan open (op een of andere manier) en de C-atomen aan beide kanten krijgen een open plek, een ongepaard elektron. Een ander atoom dat daarvoor geschikt is, kan dan die opengevallen plaats innemen.
Let wel, we hebben het niet over substitutie waarbij een atoom wordt vervangen, maar over additie waarbij een nieuwe binding wordt gemaakt met zo'n C-atoom.
Additie is dus de reactie van een onverzadigde stof die zich verzadigd met nieuw aangekoppelde atomen of atoomgroepen.
We kunnen het verschijnsel additie ook benaderen vanuit de zogenaamde π en σ-bindingen.
Die bestaan in één molecuul als de koolstofketen dubbele of drievoudige bindingen heeft.
Je kunt ook zeggen: er is overlapping van hybride-orbitalen van het type sp2 en/of sp. De beide bindingstypes σ (lineaire overlapping) en π (parallelle overlapping). Alleen de π-bindingen nemen deel aan de additie.
Voorbeeld van een mogelijk mechanisme van additie: Broom en Etheen
Etheen heeft een dubbele binding, dus een plaats met hogere elektronendichtheid (vier elektronen) en dus met hogere concentratie van negatieve lading.
Die negatieve lading wordt met name veroorzaakt door de π-elektronen.
Als een broommolecuul deze binding nadert veroorzaakt dat in het broommolecuul een soort polaire inductie en vormt zich, laten we zeggen, een (additie)brug.
Een ander broomatoom kan deze brug nu van de andere kant benaderen zoals te zien in de tekening.
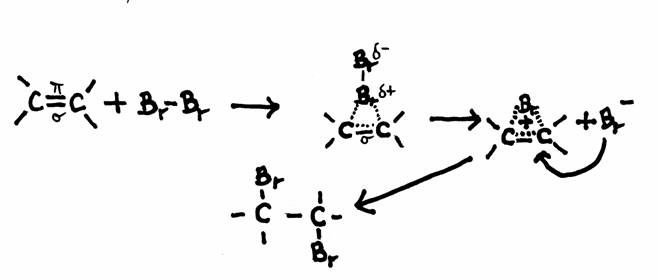
Broomwater heeft een polair en waterig milieu; de kleur is bruin-geel. Etheen is een apolair gas.
Als het etheengas de oplossing van het broomwater ingeleid wordt, vindt meteen een additiereaktie plaats: broom verbindt zich aan de dubbele binding van etheen.
Dus zal het broom tijdens de invoering van het etheengas verdwijnen. Dus ook verdwijnt beetje bij beetje de geel-bruine kleur van het broom, net zolang tot de oplossing kleurloos is.
Alkenen kunnen additie ondergaan met diverse stoffen, zoals:
Broom en de overige halogenen; Waterstof; Water; en meer.
Let op: meestal is voor een goede additie een katalysator nodig.
Bij poly-additie vormen zich macromoleculen; uitgangsstoffen zijn dan altijd onverzadigde moleculen.
