Solubilidade
Exercício 34
Escolhe a resposta certa e explique a sua escolha:
A água não dissolve aspirina, porque:
- aspirina é um sólido e água é um líquido
- moléculas de aspirina não têm carácter polar
- a água não contém o ácido do estômago
- a aspirina tem Ponto de Fusão alto demais
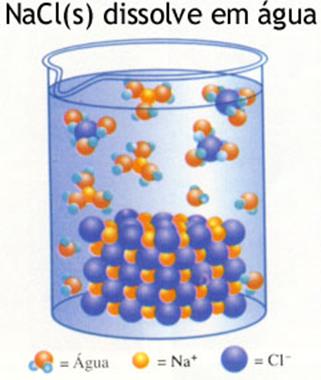
composto iónico que dissolve em água: Cloreto de Sódio
| Na+
|
Cl-
|
Na+
|
Cl-
|
Na+
|
| Cl-
|
Na+
|
Cl-
|
Na+
|
Cl-
|
| Na+
|
Cl-
|
Na+
|
Cl-
|
Na+
|
| Cl-
|
Na+
|
Cl-
|
Na+
|
Cl-
|
| Na+
|
Cl-
|
Na+
|
Cl-
|
Na+
|
| Cl-
|
Na+
|
Cl-
|
Na+
|
Cl-
|
Caso um tal cristal entra na água, aqueles iões Na+ e Cl- que escapam da rede iónica,
logo são arredondados por moléculas de água (forças de atracção polar).
A atracção entre os iões Na+ e Cl- não chega para eles voltarem para dentro da rede.
Trata-se aqui dum sal solúvel em água.
Outros iões, mais pequenos ou com mais carga, podem ter atracção suficiente para voltar,
assim apresentando um sal insolúvel em água.
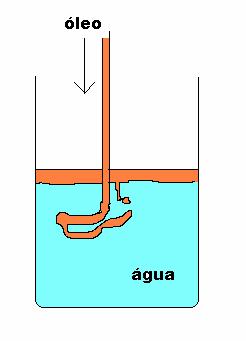
mistura heterogénea: (um exemplo: óleo + água.
As moléculas polares da água atraem-se fortemente enquanto que as moléculas apolares do óleo não conseguem misturar
com aquelas moléculas polares.
Também as apolares têm sua atracção entre si próprio.
Regra geral:
- substâncias polares atraem substâncias polares (P.e., açúcar dissolve em água)
- substâncias não-polares atraem substâncias não-polares (por exemplo, gordura em gasolina)
- substâncias polares não misturam com substâncias não-polares (por exemplo, água e óleo)
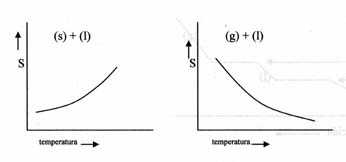
Exercício 35
Compare os dois gráficos e tire suas conclusões (S = solubilidade)
A esquerda, um sólido é dissolvido num líquido
A direita, um gás é dissolvido nom líquido
voltar ao curso


