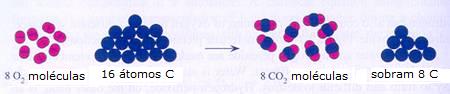
1.2 Reagentes, produtos, excesso de reagentes, produtos secundários
Reagentes e produtos reagem ou formam-se sempre numa razão fixa. Quando reagem certos reagentes, a reacção continua até acabar um dos mesmos. Sobram os restantes dos outros reagentes (que estavam em excesso).
Claro que o químico, de modo geral, tenta misturar os reagentes em quantidades ‘estequiométricas’, assim evitando falta ou excesso de reagentes. Para tal é necessário fazer os cálculos estequiométricos.
Uma outra desvantagem de não fazer estes cálculos é de não formar produtos puros no caso de sobrar certos reagentes. Os produtos ficam assim contaminados com os reagentes em excesso.
Exercício 7
Há muitas reacções que decorrem na presença de substâncias que não participam na própria reacção.
Por exemplo: as reacções de precipitação.
- Explique que reacções de precipitação decorrem na presença de substância(s) não participantes.
- Mencione um outro exemplo duma reacção que decorre na presença de substâncias não participantes.
Produtos secundários
No laboratório ou na indústria química pretendemos preparar produtos químicos. Um problema geral é de que se formam muitas vezes não só os produtos principais, mas também produtos secundários, muitas vezes inevitavelmente.
Pode ser que isto não cria nenhum problema, mas acontece também que o processo de purificação fica bastante complicado por causa disso.
Exercício 8
Na reacção de precipitação: NaCl(aq) + AgNO3(aq)  AgCl(s) + NaNO3(aq)
AgCl(s) + NaNO3(aq)
O recipiente contém os reagentes Ag+ + Cl- que produzem o produto AgCl(s).
Então, forma-se também, além do produto principal, um produto secundário que é o NaNO3(aq).
Isto somente é um exemplo simples.
Como será possível purificar o produto principal?
voltar ao curso