5.2 KS e Produto de solubilidade
Sais podem dissolver, bem ou mal, na água, produzindo muitos ou poucos iões. Os iões do sal dissolvido obtêm uma certa concentração e o produto matemático dos iões é chamado Produto Iónico.
Exercício 18
Ao dissolver 29 g NaCl num litro de água, a concentração dos iões será:
[Na+] = ......... mol/l e [Cl-] = ........ mol/l
Portanto, o produto iónico = ............. mol2/l2
Neste assunto entra o conceito equilíbrio, logo que se trata de sais pouco solúveis.
Por exemplo, cloreto de prata é um sal insolúvel (ou melhor: pouco solúvel).
Quase não existem sais realmente insolúveis. Sempre fica a possibilidade de iões escapem da rede e entrem no solvente água.
Entre o sólido (precipitado) e os seus iões na solução realiza-se um equilíbrio dinâmico:
AgCl(s)

Ag
+(aq)+ Cl
-(aq)
Exercício 19
Na maior parte deste tipo de equilíbrios, a reacção directa é endotérmica;
O que acontece com o produto iónico ao aquecer a mistura?
Depois de atingir o equilíbrio, e à temperatura constante, as concentrações já não mudam. (o sólido, sendo heterogéneo, não tem concentração).
Assim, cada sal com pouca solubilidade tem um KS, chamada: Produto de Solubilidade
O Livro de Tabelas contém uma tabela com KS de vários sais.
O sal e seus iões chegam a um equilíbrio, i.é, as concentrações já não mudam e a solução chegou a uma situação 'saturada': a esta definida temperatura, não pode dissolver mais e o PI chegou ao seu valor máximo.
Exercício 20
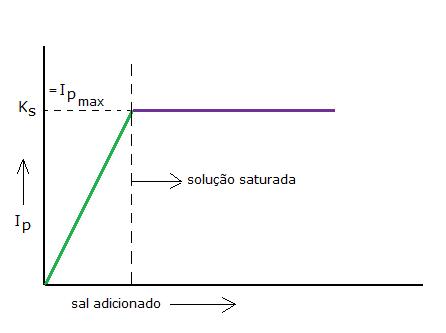
Explique o decurso do diagrama.
NB: tenha cuidado em não confundir o produto de solubilidade e a própria solubilidade do sal.
A solubilidade é o número de moles do sal que dissolve por litro de solvente (água).
O KS é o produto das concentrações dos iões do sal numa solução saturada
voltar ao curso
