6.3 pontes de Hidrogénio
Estas formas de atracção entre moléculas estão muito ligadas com a existência de dípolos, mas não são iguais.
Por exemplo, moléculas de água atraem-se por ter dípolos.
Mas para além disso existem pontes de Hidrogénio:
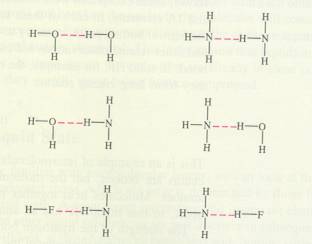
Um átomo de Hδ+ se encontra dentro de dois átomos δ- de modo linear.
Aí forma-se uma tal ponte, que chega a ter um pouco carácter de ligação covalente.
δ-
δ+
δ-
O - H - - - O
condições para realizar uma ponte de Hidrogénio:
- em total deve ser uma estrutura linear.
- sempre é necessário um Hδ+
- os átomos δ- podem ser Oxigénio, mas não necessariamente (no exemplo pode surgir Nitrogénio)
- os traços (- - -) indicam a própria ponte: um par de electrões do Oxigénio soffreu um pouco da influência do Hidrogénio, começando assim uma ligação de carácter covalente.

voltar ao curso

