O exemplo mais famoso é o ião amónio. NH4+ pode ceder um ião H+, portanto, é um ácido de acordo com a definição.
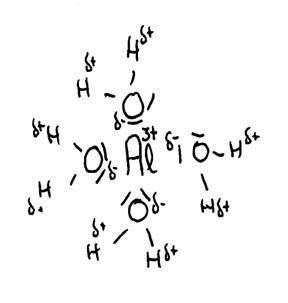
Mas existem outros, por exemplo: Al(H2O)63+.
Falamos aqui dos iões multipositivos dos metais: Al3+ , Cu2+, Fe2+ ou Fe3+, e outros. Estes iões positivos atraem, em meio aquoso, os lados negativos das moléculas de água, criando uma repulsão aos átomos de Hidrogénio (que têm uma carga δ+). Isto cria a possibilidade real de cedência de H+.
Uma solução, por exemplo, de cloreto de Ferro(III) pode obter um meio bastante ácido.
O desenho em cima mostra a atracção entre o Al3+ e a parte δ- de Oxigénio, e a parte δ+ de Hidrogénio.
As moléculas de água (em total 6) arredondam o ião 3+ do Alumínio.
Assim a distância entre 3+ e δ+ torna-se pouca, com a consequência de repulsão:
voltar ao curso