1.2 Volume de gases
Qualquer gás, à temperatura de 0oC e uma pressão de 1 atm. tem um volume de 22,4 litros por MOL (= volume molar dos gases). O volume dos gases não depende do tamanho das moléculas, mas sim da distância entre as moléculas.
N.B. cada gás tem o mesmo volume molar, mas não a mesma massa molar!! As moléculas de Hidrogénio são muitíssimo mais leve do que as moléculas de butano.
Não importe qual seja o gás, mas o volume que ocupa é igual em todos os casos a definida temperatura e pressão. Ou, por outras palavras:
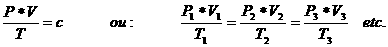
A temperatura T é dada em Kelvin!
A pressão em Nm2
O volume em m3
A constante c= n x Rn é o número de moles e R = 0,0821 J x mol-1 x K-1
Exercício 11
Calcule o volume de 10 gramas do gás hidrogénio, 10 gramas do gás Hélio e 10 gramas do gás butano, todos medidos a 0oC e 1atm.
Exercício 12
No Exercício anterior surge um problema prático: a 0oC e 1atm., o gás butano já não é gasoso; mas tornou-se um líquido.
- o que diz isso acerca do ponto de ebulição de butano?
- qual a implicação para o volume calculado?
Exercício 13
Calcule o volume de gás a uma temperatura de 25oC e 76mmHg.
voltar ao curso
![]()