ESPECTROMETRIA
Caso juntar energia extra às partículas duma substância (átomos, iões, moléculas), por exemplo por aquecimento ou radiação, esta substância pode recolher (uma parte d)aquela energia.
Então, onde fica aquela energia? (alias, energia nunca se perde, não é?)
A energia recolhida pode chegar dentro duma tal partícula duma ou doutra maneira e armazenada.
- A energia é recolhida pelos electrões dum certo átomo.
Quanto mais energia contem o electrão, tanto mais autónomo este electrão.
por outras palavras:
Quanto mais afastados do núcleo (do átomo), tanto mais autónomo e mais energia terá o electrão.
Imagine que a energia oferecida (suficiente) chega nos electrões. Com tanta energia estes electrões mudam para uma cadeia mais afastada do núcleo (veja B)
Até é possível que um tal electrão recolhe tanta energia que se formará um ião positivo (veja A).
- Um ou mais electrões recebem e recolhem tanta energia, suficiente para afastar-se completamente do átomo; isto chamamos 'ionisação' e isto não cria um espectro.
- Um electrão recolhe energia e muda para uma camada mais exterior. A energia recolhida fica naquele electrão, ainda, e por isso já não é estàvel. Quanto mais energia dentro duma partícula, mais instável é. Aquela partícula instável encontra-se num "ESTADO AGITADO".
Electrões com energia demais rapidamente (dentro de fracções de segundo) voltam para a sua posição original (ESTADO FUNDAMENTAL). Este regresso podem realisar em passos, via outros sub-níveis.
Durante cada passo o electrão deve liberar uma porção de energia de forma raio electromagnético dum certo comprimento da onda.
A maneira dos electrões de voltar ao seu estado fundamental depende do tipo de átomo. Portanto, também o tipo de raio emitido pode variar.
Aquele raio podemos observar e medir, mesmo com o olho nu, quando o compromento da onda fica entre 400 e 700 nm.
- A energia é absorvida pelas moléculas.
Dentro das moléculas, os átomos, mesmo ligados entre si, ficam em vibração, cada átomo na sua própria maneira. Ao fornecer energia e quando esta energia não chega para remover electrões, neste caso aquela vibração vem na vista.
Para tal muitas vezes é fornecida luz vermelho. Esta radiação, (parcialmente) absorvida pela molécula, causa mais vibração e/ou mudanças na direcção das vibrações. Realisa-se um tipo de estado agitado que também não é estável.
A molécula instável voltará imediatamente para o estado original, emitindo radiação nova. Estes novos raios podemos medir com espectrómetros.
Conclusões acerca do carácter da substância investigada podemos tirar destas medições .
- A energia é recolhida pelo NUCLEO do átomo.
Núcleos também podem recolher certa energia e, depois, ceder. Também aqui podemos criar um espectro (NMR).
Neste caso o campo magnético tem um papel importante.
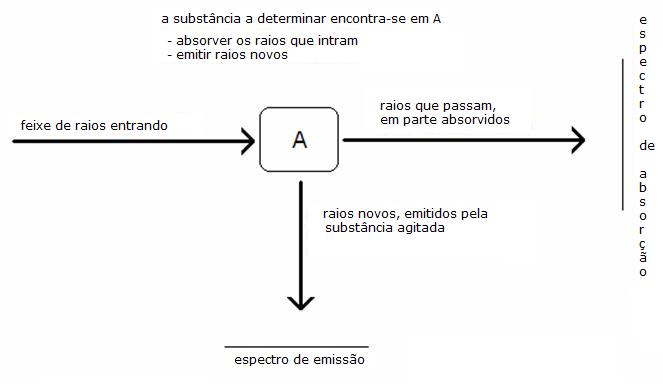 Podemos distinguir dois espectros diferentes:
Podemos distinguir dois espectros diferentes:
- O espectro de absorção
- O espectro de emissão
Uma feixe de luz com certo comprimento da onda (variável) enviamos pela substância a investigar. A certos comprimentos da onda específicos, a substância vai absorver uma certa quantidade da luz. Com a consequência de a feixa continua com menos radiação daquele(s) comprimento(s) da luz.
O detector vai notar isto e assim formar uma ponta, um auge no gráfico.
As moléculas agitadas não são estáveis e (rapidamente) voltam para seu estado original (fundamental). Durante esta volta, nova radiaçã é emitida em todas as direcções.
Também estes raios de emissão podemos detectar (na imagem sob ângulo de 90 graus) e desenhar num gráfico. Podemos observar no gráfico pontas / auges específicos.
O padrão do espectro muitas vezes indica o tipo da molécula ou mesmo a própria molécula.
Pode comparar com uma dedada, uma impressão digital dos átomos ou moléculas..
voltar ao curso
 Podemos distinguir dois espectros diferentes:
Podemos distinguir dois espectros diferentes: