A matéria e a energia
Substâncias contêm energia.Pode ser muito, pode ser pouco, mas sempre há energia química na matéria de modo latente ou
potencial. Esta energia interna pode manifestar-se em certas circunstâncias, sempre quando a substância sofre qualquer reacção química.
Os vários tipos de energia que existem são: radiação, cinética, eléctrica, química, potencial.
Exercício 47
Explique como é que os explosivos são substâncias com muita energia química.
Exercício 48
Estimando as energias internas, ponha as seguintes substâncias numa ordem crescente de energia química: gasolina, água, T.N.T., hidrogénio, dióxido de carbono, cloreto de sódio, enxofre, madeira, açúcar.
Energia nos nutrientes
O corpo humano precisa de comida, em parte para recolher todas as substâncias necessárias, mas também para obter energia.
Os nutrientes específicos que fornecem energia são os carbohidratos, i.é, os sacarídeos (mono-, di- e polisacarídeos).
Exercício 49
Quais os nutrientes mais consumidos pelo homem na vida quotidiana para obter energia?
Dá exemplos concretos.
Exercício 50
No corpo humano, esses nutrientes são modificados em produtos.
São reacções exotérmicas ou endotérmicas?
Justifique a sua resposta.
Fornecendo energia a uma substância, normalmente, implica que a substância obtém um aumento de temperatura
(as partículas obtêm mais movimento).
Só que no caso de mudança de fase, as partículas precisam de energia extra para realizar trabalho extra: deslocam-se, afastam-se, etc.
Naqueles momentos, toda a energia fornecida é usada para tal, e a temperatura da substância em mudança não aumenta.
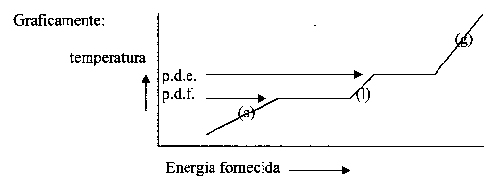
Exercício 51
Quais as extrapolações do gráfico? Ou seja: a que mínimo vai a temperatura e a que máximo?
As substâncias / elementos mais importantes na combustão são: hidrogénio e carbono, com produtos de combustão: água e dióxido de carbono.
O carvão contém muito carbono, o gás natural contém mais hidrogénio. Em geral, os combustíveis mais importantes são os hidrocarbonetos que se encontram e são derivados de petróleo.
Na reacção com oxigénio, primeiro o hidrogénio reage com oxigénio:
( H2O) e depois reage o carbono
(
H2O) e depois reage o carbono
( CO2).
No caso de ter pouco oxigénio, podemos formar CO ou mesmo ficamos com o próprio carbono,
CO2).
No caso de ter pouco oxigénio, podemos formar CO ou mesmo ficamos com o próprio carbono,
exemplo: negro de fumo. Isto acontece quando o motor dum carro não funciona bem (não entra oxigénio suficiente).
Aquecer o carvão na ausência de oxigénio dá coques que é composto por mais de 90% de grafite, é um bom combustível.
A formação de CO2, hoje em dia, acontece em quantidades enormes. A consequência é que a percentagem mundial de CO2 está aumentando e cria o aumento da temperatura mundial. Assim muda o clima mundial.
Exercício 52
De que maneira é que o seu País contribui ao aumento do teor de CO2 na atmosfera?
Etanol pode ser produzido em quantidades grandes, por exemplo crescendo açúcar (cana doce) com posterior fermentação.
O biogás é a mistura de gases (com muito metano) formado na fermentação bacterial de água preta.
Hidrogénio pode ser feito de água num processo de electrólise. Só que, donde vem a energia para executar a electrólise?
Deve estar claro que o homem vai precisar de fontes de energia alternativa (vento, solar, mais)
Exercício 53
O combustível mais desejado seria o hidrogénio. Porquê?
Existem fontes de energia alternativa, não químicas: energia nuclear, turbinas ligadas às barragens, a força do vento a ventoinhas e energia solar.
A função das baterias e pilhas é o fornecimento de energia eléctrica. A pilha e a bateria devem conter energia na forma química; são certas substâncias ricas com energia. No módulo sobre reacções redox explicamos como as substâncias (oxidantes e
redutores) dentro da pilha/bateria transferem electrões.
Esta transferência cria a corrente eléctrica.
Uma pilha morta implica que acabaram as substâncias energéticas. No caso de pilhas recarregáveis e baterias, é possível
recuperar as mesmas substâncias originais, através de reacções químicas reversíveis.
voltar ao curso
