Diagramas de energia
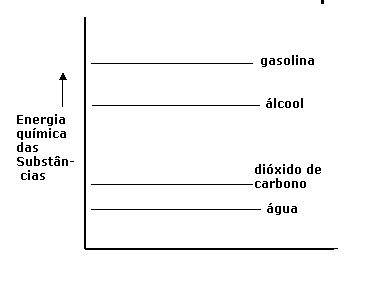
No caso de gasolina em reacção com Oxigénio (são duas substâncias com bastante energia interna) formam-se os produtos água e dióxido de carbono, duas substâncias com pouca energia interna. Claro que, durante esta reacção, houve perca de energia química ou energia interna, que não pode simplesmente desaparecer.
Aquela energia liberta-se de outra forma: calor na maioria das vezes. A diferença entre a energia química dos reagentes e produtos, é chamada ‘energia da reacção’, com o símbolo ∆H.
No caso de libertação de energia, ∆H apanha um valor negativa (o sistema perde energia e a reacção é exotérmica).
No caso de necessidade de energia, ∆H tem sinal positivo: o sistema ganha energia e a reacção é endotérmica.
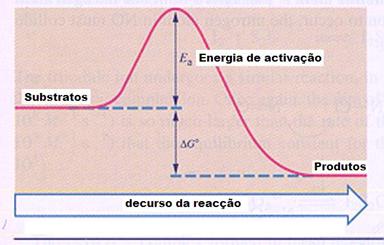
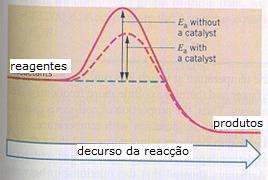
reagentes formam produtos, seja sem ou com catalisador.
ΔGo apresenta a energia da reacção e muitas vezes usamos o símbolo ΔH.
Ea é a energia de activação.
voltar ao curso


