O átomo de Carbono
O átomo de Carbono é especial, por várias razões:
- Pode ter 4 ligações, o que é muito, comparado com outros átomos.
- Liga facilmente com outros átomos de Carbono, diferente dos outros átomos, que preferem ligar com átomos de elementos diferentes.
As quatro ligações podem obter carácteres diferentes, assim causando a existência de ligações simples, duplas, triplas e
aromáticas. Para explicar isto, será necessário entrar nos orbitais s e p que podem misturar (hibridisar) e formar orbitais mistas ou híbridas: sp3, sp2, sp.
Os subníveis do átomo de Carbono são: 1s2 2s2 2p2.
A primeira camada principal 1s2 não sofre nenhuma mudança durante o processo de hibridisação, nem durante as reacções químicas. Mas a segunda camada sofre uma certa reorganização:
Os 4 electrões de valência (dois s e dois p) têm uma estratégia de chegar a uma situação mais estável:
- Primeiro: um electrão 2s muda para (torna-se) 2p
2s2 2p2
 2s1 2p3 (isto custa alguma energia)
2s1 2p3 (isto custa alguma energia)
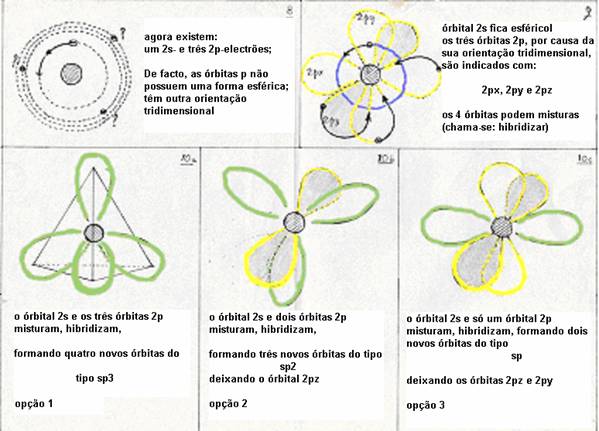
- Depois: os quatro níveis (um s e três p) podem misturar, assim formando hibridas: são quatro novos orbitais do tipo sp3
Um 2s-orbital e três 2p-orbitais participam na hibridização
2s1 2p3
 4 novos orbitais sp3 (é um processo exotérmico; cria uma situação mais estável para o átomo de Carbono).
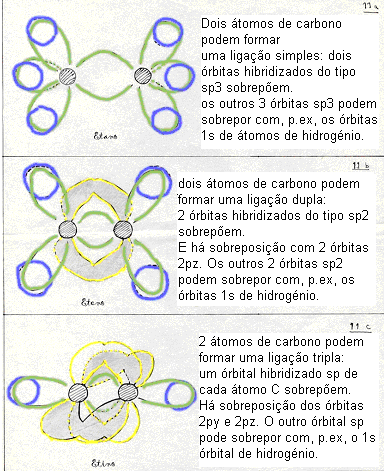
Estes 4 orbitais são iguais e responsáveis para as 4 ligações (σ) do átomo de C.
4 novos orbitais sp3 (é um processo exotérmico; cria uma situação mais estável para o átomo de Carbono).
Estes 4 orbitais são iguais e responsáveis para as 4 ligações (σ) do átomo de C.
Além dessa hibridização existem duas outras possibilidades:
- Já encontrámos a hibridização até sp3. As quantro orbitais de Carbono participam.
- Um participam na hibridização; sobra um 2porbital.
2s + 2p  3 novos orbitais do tipo sp2
3 novos orbitais do tipo sp2
o antigo orbital 2p que sobrou pode participar numa ligação dupla (que é constituída por uma ligação σ e uma ligação π).
- Um 2s e um 2p participam na hibridização, sobrando dois 2p
2s + p 2 novos orbitais do tipo sp
Os dois antigos orbitais 2p podem participar numa ligação tripla (uma ligação σ e duas ligações π).
2 novos orbitais do tipo sp
Os dois antigos orbitais 2p podem participar numa ligação tripla (uma ligação σ e duas ligações π).
O número total das ligações do átomo de Carbono normalmente fica 4. Quando todas as ligações numa molécula orgânica são do tipo σ, a molécula é alifática.
Em benzeno e substâncias semelhantes, os três orbitais do tipo sp2 formam três ligações σ (enquanto que os seis 2p orbitais sobrepões-se, assim estabilizando a molécula com esta quarta ligação especial do tipo π
Uma molécula deste tipo é aromática.
Exercício 14
Explique cada parte da banda desenhada em baixo, que pretende explicar o átomo de Carbono.
Mais uma opção é de ver a apresentação com PP do mesmo fenómeno
O átomo de Hidrogénio é o átomo mais simples com um só electrão. A distribuição electrónica é: 1s1.
Não há hibridização. O orbital s tem a forma esférica e sobrepõe com qualquer outro orbital de qualquer outro átomo, por exemplo os orbitais do átomo de Carbono. Este tipo de sobreposição sempre é do tipo σ e somente surge em ligações simples.
Exercício 15
Explique por que é que o Hidrogénio nunca forma ligações duplas.
Exercício 16
Explique o seguinte símbolo: sp2, usando as suas próprias palavras.
voltar ao curso