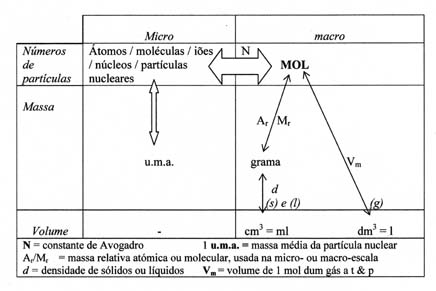
O diagrama em baixo mostra umas relações entre as unidades no micro-nível (átomos etc.) e no mácro-nível (gramas etc.) com a unidade MOL no centro:
Exemplo 1:
Da substância CuSO4.5H2O temos 4 gramas. (são cristais hidratados)
São quantas MOLes? consulte o livro de tabelas
resposta:
De grama para MOL deve-se usar a massa molecular, neste caso: Cu + S + 4O + 10H + 5O = 63,5 + 32,1 + 64 + 10 + 80= 249,6
249,6 gramas da substância CuSO4.5H2O = 1 MOL CuSO4.5H2O.

 1 grama = 1/249,6 MOL
1 grama = 1/249,6 MOL
 4 gramas = 4 x 1/249,6 MOL = 0,016 MOL
4 gramas = 4 x 1/249,6 MOL = 0,016 MOL
4 gramas de CuSO4.5H2O encontram-se em 0,016 MOL CuSO4.5H2O
ou seja:
0,016 MOL CuSO4.5H2O têm uma massa de 4 gramas
ou:
4 gramas de CuSO4.5H2O são 0,016 MOL CuSO4.5H2O
Exemplo 2:
Imagine que num copo (pequeno) de cerveja (100 mls) se encontram 5 mls de álcool (C2H5OH. Isto é: a VOL% é 5); a densidade de álcool=0,8g/ml), quantas gramas de álcool encontram-se num litro de cerveja?
resposta:
A resposta deve indicar gramas e conhecemos o álcool em mls
5 mls de álcool por 100ml de cerveja  50 mls de álcool por 1000 ml de cerveja (1 litro)
50 mls de álcool por 1000 ml de cerveja (1 litro)
Não queremos mls de álcool, mas gramas. Portanto, é necessário usar a densidade d:
d = 0,8  1 mililitro de álcool tem uma massa de 0,8 gramas
1 mililitro de álcool tem uma massa de 0,8 gramas
 50 mls têm uma massa de 50 x 0,8 gramas (= 40 gramas).
50 mls têm uma massa de 50 x 0,8 gramas (= 40 gramas).
 1 litro de cerveja (=1000 mls) contém 40 gramas de álcool.
1 litro de cerveja (=1000 mls) contém 40 gramas de álcool.
[quem toma um copo de cerveja (= 100 mls de cerveja) consume 5 mls = 4 gramas de álcool. Um copo grande dá 8 gramas de álcool]
Exercício 9
Explique aos seus colegas o significado de cada seta no esquema.
Exercício 10
verdadeira ou falsa? explique!
- 12 g de Carbono contêm 1 mol de átomos
- 28 g de Nitrogénio contêm 1 mol de moléculas
voltar ao curso

![]() 1 grama = 1/249,6 MOL
1 grama = 1/249,6 MOL
![]() 4 gramas = 4 x 1/249,6 MOL = 0,016 MOL
4 gramas = 4 x 1/249,6 MOL = 0,016 MOL