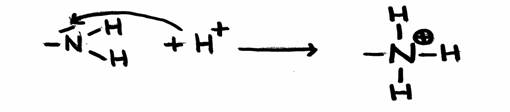
Em geral são aqueles substâncias que contêm Nitrogénio com um par isolado de electrões. Podemos pensar nas moléculas das aminas, e os aminoácidos.
Exercício 15
Apresente a equação da reacção com um ácido em fórmulas moleculares de:
- amino-etano;
- Alanina.
Exercício 16
Apresente uma substância orgânica sendo uma base diprotónica.
Em princípio, todos os iões negativos podem captar iões H+. Assim, todos são bases, seja fortes ou fracas.
Aqueles muitíssimo fracos acabam de ser bases, como Cl-. Já não ficam com carácter básico real.
Exercício 17
Coloque em ordem crescente de basicidade, as seguintes partículas; use para tal a tabela de ácidos / bases:
Br- 0H- HCO3- H2PO4- CH3COO- CH2ClCOO- SO42- HSO4-
Aqueles iões catiónicos, depois de ter cedido um ou mais iões H+, podem recaptar este ião H+, assim apresentando uma base.
Nota bem que esta base – muitas vezes - também pode servir de ácido (ceder mais protões) e a própria partícula é assim anfotérica.
| Al(H2O)63+ | + | H2O | Al(OH)(H20)52+ | + | H3O+ | |
| ácido | base | base | ácido |
Exercício 18
Na equação acima, indique porquê as substâncias são ácidos e bases como indicado, e determine a que lado constam as substâncias fracas.
Por exemplo o amoníaco e a água (sendo água anfotérica).
Exercício 19
Quando reagem os gases amoníaco e cloreto de hidrogénio, forma-se um fumo branco.
- Dá a equação desta reacção em fórmulas moleculares
- Explique por que é que esta reacção será uma reacção ácido base