6.2 KW
No módulo 9 já foi discutido o facto de água própria é um anfólito fraco, portanto: água é uma base muito fraca é um ácido muito fraco.
Sem outras substâncias na água, o pH a 25 graus centígrados é exactamente 7, e também o pOH=7
Ao equilíbrio de água pertence também uma K:
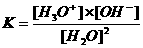
A concentração da água [H2O] = constante.
Exercício 63:
Explique que a concentração da água em água = ±55,5 mol/l. A dissociação de água em iões praticamente não muda nada.
Do anterior podemos tirar a conclusão seguinte:
K.[H2O]2 = [H3O+].[OH-]
 K·55,5 = Kw = 10-7·10-7 = 10-14
K·55,5 = Kw = 10-7·10-7 = 10-14
Kw chamaos a constante de água que, a 25°C = 10-14.
Tal como todas as constantes de equilíbrio, também a constante de água somente depende da temperatura.
Exercício 64:
Mede o pH de água fervida:
- logo depois de ferver
- depois de ter arrefecida
As fórmulas podemos escrever com valores p:
pKw = pH + pOH ou em números: pKw = 14 = 7 + 7
No caso de pH e pOH terem valores iguas, portanto a [H3O+] e a [OH-] são iguais, a solução é neutra.
Uma vez Kw é uma constante, (tal como pKw), a soma de pH e pOH também será constante = 14
por exemplo: pH = 5 e pOH = 9.
Aumentando o pH, o valor de pOH diminue e v.v.
- Adição de ácido, a [H3O+] aumentando, o pH <
- Adição de base, a [OH-] aumentando, o pOH <
voltar ao curso